保健食品清理換證近20年艱難落地之路及換證審評(píng)內(nèi)容
2023-09-13
自2023年8月31日國(guó)家市場(chǎng)監(jiān)管總局發(fā)布《 允許保健食品聲稱的保健功能目錄 非營(yíng)養(yǎng)素補(bǔ)充劑(2023年版)》及其配套解讀文件后,很多企業(yè)咨詢我們“清理換證”的相關(guān)問題,為使大家對(duì)其有更清晰、全面的理解,以便穩(wěn)步推進(jìn)換證工作,我們整理本篇分享給大家,今天發(fā)布第一部分《保健食品清理換證近20年艱難落地之路及換證審評(píng)內(nèi)容》,明天發(fā)布第二部分《保健食品清理換證96-05年7000余“雙無”產(chǎn)品清單》。
清理換證落地之路
早在2004年國(guó)家相關(guān)部門即已開始謀劃“清理換證”?;仡櫄v史,“清理換證”政策落地一路走來甚為艱難,時(shí)間跨越近20年,歷經(jīng)原國(guó)家食品藥品監(jiān)督管理局(SFDA)、原國(guó)家食品藥品監(jiān)督管理總局(CFDA)和國(guó)家市場(chǎng)監(jiān)督管理總局(SAMR)。
01、SFDA時(shí)代
2004年12月24日,原國(guó)家食品藥品監(jiān)督管理局藥品注冊(cè)司下發(fā)《關(guān)于開展保健食品注冊(cè)有關(guān)情況調(diào)查的通知》(食藥監(jiān)注函[2004]152號(hào)),開啟清理換證摸底普查之路。
2005年3月30日,國(guó)務(wù)院辦公廳關(guān)于印發(fā)《2005年全國(guó)食品藥品專項(xiàng)整治工作安排的通知》(國(guó)辦發(fā)〔2005〕20號(hào))提及:“認(rèn)真開展保健食品清理、換證工作”。
2005年9月20日,原國(guó)家食品藥品監(jiān)督管理局(SFDA)下發(fā)《保健食品清理換證方案(征求意見稿)》。
2005年11月24日,原國(guó)家食品藥品監(jiān)督管理局(SFDA)再發(fā)布征求《保健食品清理換證方案(送審稿)》意見的通告,附件1中列出29個(gè)已撤銷保健食品批準(zhǔn)證書的清單。
2009年7月21日,原國(guó)家食品藥品監(jiān)督局發(fā)布《關(guān)于開展保健食品基本情況調(diào)查和確認(rèn)工作的通知(食藥監(jiān)辦許函[2009]280號(hào)) 》,表示將適時(shí)開展保健食品產(chǎn)品清理換證和再注冊(cè)工作,對(duì)衛(wèi)生部和國(guó)家局批準(zhǔn)的保健食品產(chǎn)品基本情況進(jìn)行調(diào)查摸底和確認(rèn)。
2010年5月5日,原國(guó)家食品藥品監(jiān)督局(SFDA)印發(fā)《2010年保健食品安全整頓工作實(shí)施方案》,表示:“待《保健食品監(jiān)督管理?xiàng)l例》出臺(tái)后,依法對(duì)獲批注冊(cè)但未標(biāo)明有效期的保健食品進(jìn)行全面清理換證。”
2012年9月18日,原國(guó)家食品藥品監(jiān)督局(SFDA)發(fā)布《保健食品清理換證工作方案(征求意見稿)》意見的函(食藥監(jiān)保化函[2012]425號(hào))。
02、CFDA時(shí)代
2013年3月14日,根據(jù)第十二屆全國(guó)人民代表大會(huì)第一次會(huì)議審議通過的《國(guó)務(wù)院機(jī)構(gòu)改革和職能轉(zhuǎn)變方案》,組建國(guó)家食品藥品監(jiān)督管理總局(CFDA),不再保留國(guó)家食品藥品監(jiān)督管理局(SFDA)。
2015年3月25~26日,全國(guó)保健食品監(jiān)督管理工作會(huì)議在北京召開,會(huì)議指出“完善注冊(cè)、備案管理制度,全面啟動(dòng)清理換證”。
2015年10月1日,新食安法正式實(shí)施。
2016年2月26日,國(guó)家食品藥品監(jiān)督管理總局(CFDA)發(fā)布《保健食品注冊(cè)與備案管理辦法》解讀,第十七條:“對(duì)現(xiàn)有已批準(zhǔn)注冊(cè)的保健食品,采取分期分批、依法合規(guī)、穩(wěn)步推進(jìn)的原則開展清理換證工作。通過清理換證,使新老產(chǎn)品審評(píng)標(biāo)準(zhǔn)保持一致。清理換證方案另行規(guī)定。”
03、SAMR時(shí)代
2018年3月13日,根據(jù)第十三屆全國(guó)人民代表大會(huì)第一次會(huì)議審議通過的《國(guó)務(wù)院機(jī)構(gòu)改革方案》,組建國(guó)家市場(chǎng)監(jiān)督管理總局(SAMR),不再保留國(guó)家食品藥品監(jiān)督管理總局(CFDA)。
2019年8月20日,國(guó)家市場(chǎng)監(jiān)管總局召開專題新聞發(fā)布會(huì),介紹《保健食品標(biāo)注警示用語指南》和《保健食品原料目錄與保健功能目錄管理辦法》總體情況,表示會(huì)有序開展換證清理工作。
2022年1月13日,國(guó)家市場(chǎng)監(jiān)管總局(SAMR)發(fā)布《關(guān)于發(fā)布允許保健食品聲稱的保健功能目錄 非營(yíng)養(yǎng)素補(bǔ)充劑(2022年版)及配套文件》的公告(征求意見稿),納入新舊功能的銜接措施,即俗稱的“清理換證”。
2023年8月31日,國(guó)家市場(chǎng)監(jiān)管總局發(fā)布《允許保健食品聲稱的保健功能目錄 非營(yíng)養(yǎng)素補(bǔ)充劑(2023年版)》,配套解讀文件中明確了“老功能聲稱”和“雙無”產(chǎn)品過渡要求,至此“清理換證”終于落地。
清理換證審評(píng)內(nèi)容
根據(jù)《 允許保健食品聲稱的保健功能目錄 非營(yíng)養(yǎng)素補(bǔ)充劑(2023年版)》及其配套解讀文件(以下簡(jiǎn)稱“23版功能目錄”),保健功能調(diào)整為24個(gè),較之03版,刪除“改善生長(zhǎng)發(fā)育”、“促進(jìn)泌乳”和“改善皮膚油分”。設(shè)置5年過渡期,企業(yè)需在5年內(nèi)完成換證工作。
01、“老功能聲稱”產(chǎn)品
對(duì)于列入23版功能目錄的產(chǎn)品,相對(duì)簡(jiǎn)單,僅僅規(guī)范保健功能聲稱,企業(yè)可單獨(dú)提出功能名稱變更,也可在辦理其他變更、延續(xù)等事項(xiàng)時(shí)規(guī)范;在審產(chǎn)品審評(píng)機(jī)構(gòu)將直接調(diào)整,企業(yè)無需操作;對(duì)于未列入23版功能目錄的產(chǎn)品,可申請(qǐng)納入(難度巨大)或放棄此功能去變更23版目錄內(nèi)功能。
02、“雙無”產(chǎn)品
“雙無”產(chǎn)品主要是指2005年7月1日前原衛(wèi)生部和國(guó)家食品藥品監(jiān)督管理局(SFDA)批準(zhǔn)的保健食品,其頒發(fā)的保健食品批準(zhǔn)證書未注明證書的有效期,也無技術(shù)要求。據(jù)健研申訊最新統(tǒng)計(jì),原衛(wèi)生部自1996年11月4日至2003年7月8日,共批準(zhǔn)5200個(gè)(含已注銷/撤消產(chǎn)品),其中衛(wèi)食健字4749個(gè),衛(wèi)食健進(jìn)字237個(gè),衛(wèi)進(jìn)食健字214個(gè);原國(guó)家食品藥品監(jiān)督管理局(SFDA)自2003年10月完成原衛(wèi)生部移交工作、正式啟動(dòng)保健食品審批工作至2005年7月1日前,共計(jì)批準(zhǔn)2132個(gè)。因此,“雙無”產(chǎn)品總共估計(jì)7000余個(gè),占到目前批準(zhǔn)功能產(chǎn)品的1/3以上,涉及企業(yè)4700余家,可見清理換證規(guī)模之龐大,影響之廣泛,將會(huì)對(duì)保健食品批文格局以及市場(chǎng)產(chǎn)生重大變化和深遠(yuǎn)影響。也由此不難理解,清理換證落地之所以歷時(shí)近20年之久,工作之繁重,任務(wù)之艱巨,牽一發(fā)而動(dòng)全身。在此向?yàn)橥苿?dòng)清理換證落地付出艱苦卓越努力的國(guó)家局、各地省局以及協(xié)會(huì)、專家等致敬!
據(jù)悉,“清理換證”將采取分期分批、依法合規(guī)、穩(wěn)步推進(jìn)的原則開展清理換證工作,最終使新老產(chǎn)品審評(píng)標(biāo)準(zhǔn)保持一致。“雙無”產(chǎn)品需首先通過省級(jí)市場(chǎng)監(jiān)管部門意見,對(duì)于在生產(chǎn)產(chǎn)品,會(huì)優(yōu)先處理,而未進(jìn)行過實(shí)際生產(chǎn)“閑置”產(chǎn)品換證之路或許較為艱難坎坷,我們建議有條件的企業(yè)可咨詢各地省局考慮盡快落證生產(chǎn)。另外,原功能依據(jù)為96版評(píng)價(jià)方法的產(chǎn)品,有8個(gè)功能需補(bǔ)做功能試驗(yàn),建議企業(yè)盡快送檢,在檢驗(yàn)期間同步進(jìn)行換證其他工作,以縮短換證周期。
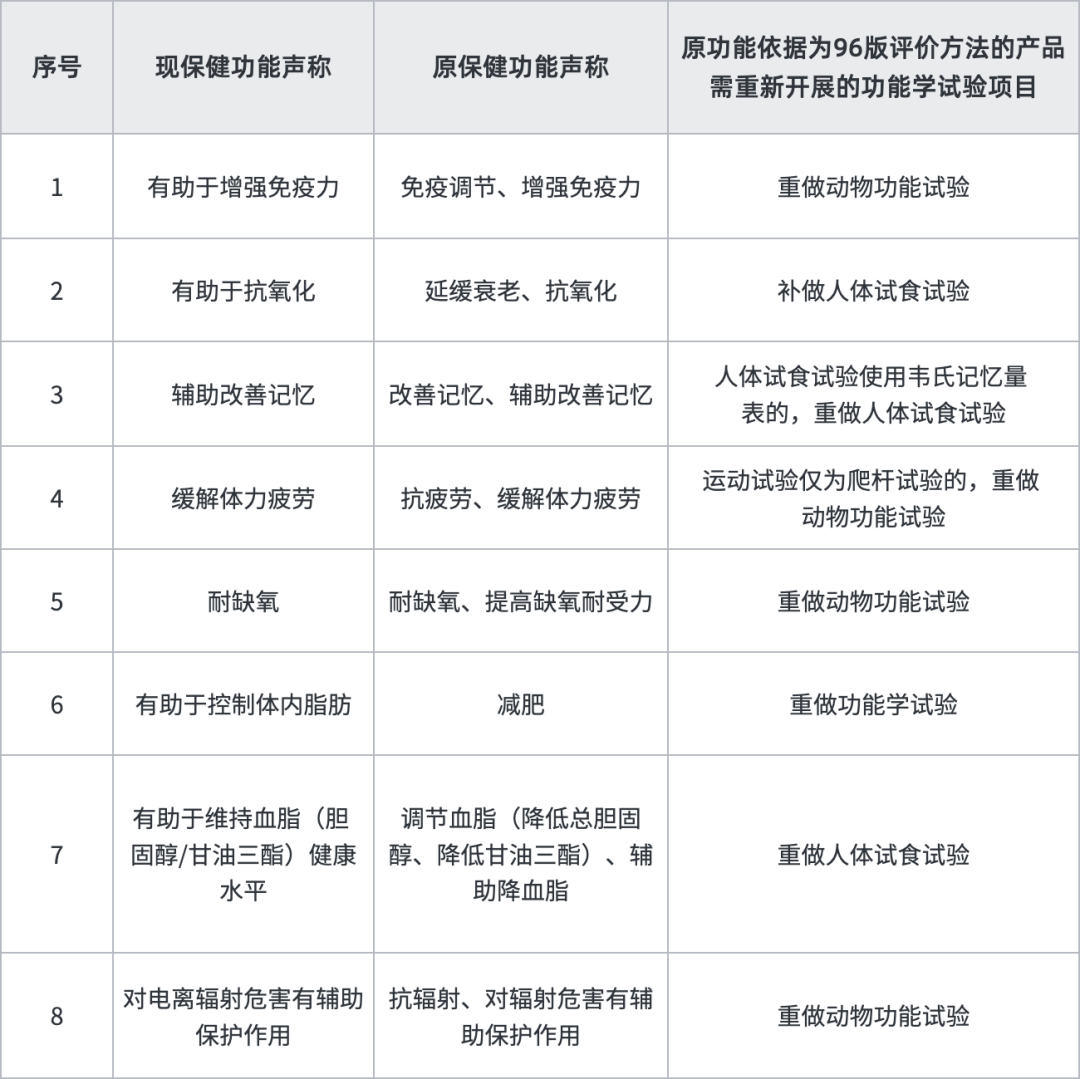
按照我們經(jīng)驗(yàn),換證審評(píng)除上述明確補(bǔ)做內(nèi)容外,將會(huì)對(duì)保健食品產(chǎn)品名稱、說明書(如標(biāo)示值、服用量、適宜人群等)、技術(shù)要求(如標(biāo)志性成分,提取物工藝等)及生產(chǎn)工藝按照新法規(guī)進(jìn)行審評(píng)予以規(guī)范,比如:不屬于普通食品、新食品原料、食品添加劑及可用物品名單內(nèi)的原料或用量不符合現(xiàn)行規(guī)定的需提供食用安全的文獻(xiàn)等資料或要求調(diào)整用量;無標(biāo)志性成分或標(biāo)志性成分檢測(cè)方法不符合現(xiàn)行規(guī)定的,需補(bǔ)訂標(biāo)志性成分以及提供方法學(xué)驗(yàn)證資料;產(chǎn)品技術(shù)要求缺少指標(biāo)的須按國(guó)家現(xiàn)行標(biāo)準(zhǔn)增訂,增訂指標(biāo)屬于穩(wěn)定性重點(diǎn)指標(biāo)的還需要提供三批穩(wěn)定性報(bào)告。存在以下情形者預(yù)計(jì)將不予換證:(1)未在規(guī)定時(shí)限內(nèi)提出換證申請(qǐng)或補(bǔ)充資料未在規(guī)定時(shí)限內(nèi)提交或不符合要求;(2)原輔料、產(chǎn)品不符合現(xiàn)行規(guī)定(比如原料為一級(jí)野生動(dòng)植物保護(hù)品種或其他禁用物品),存在食用安全問題的;(3)生產(chǎn)工藝無法重現(xiàn),不符合現(xiàn)行規(guī)定的;(4)國(guó)家相關(guān)部門已撤銷的保健食品批準(zhǔn)證書。
保健食品清理換證服務(wù)
很多企業(yè)比較關(guān)心換證費(fèi)用和周期,這需要根據(jù)每個(gè)產(chǎn)品不同情況做出具體分析,費(fèi)用少則免費(fèi),多則幾十萬,周期少則幾個(gè)月,多則三四年。近幾年我們已幫助一些先行的企業(yè)進(jìn)行換證相關(guān)工作,以變更事項(xiàng)遞交,獲得寶貴的審評(píng)意見和經(jīng)驗(yàn),歡迎企業(yè)與我們交流,我們會(huì)對(duì)換證產(chǎn)品進(jìn)行全面評(píng)估和分析,提供經(jīng)濟(jì)、可行、保障的換證方案,依法合規(guī)、穩(wěn)步推進(jìn),從而確保5年內(nèi)順利換證!

